Cientistas brasileiros e franceses mostram que inibir a interação entre duas proteínas-chave para o alongamento da parede celular pode ser estratégia eficaz para matar bactérias do tipo bacilo
Em um artigo publicado na Nature Communications no dia 3 de outubro, um grupo que reúne cientistas do Brasil e da França descreve uma nova estratégia para matar bactérias do tipo bacilo – aquelas que possuem forma alongada, semelhante à de uma cápsula.
Pertencem a esse grupo diversas espécies causadoras de doenças em humanos como Escherichia coli, Pseudomonas aeruginosa e Helicobacter pylori.
“Nossos achados abrem caminho para o desenvolvimento de medicamentos antibióticos com mecanismo de ação completamente diferente do encontrado nas drogas usadas atualmente, podendo ser útil no tratamento de infecções por patógenos resistentes”, disse Andréa Dessen, pesquisadora do Instituto de Biologia Estrutural (IBS) em Grenoble, na França, e também do Laboratório Nacional de Biociências (LNBio), em Campinas.
O trabalho foi coordenado por Dessen e contou com apoio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) por meio do Programa São Paulo Excellence Chair (SPEC), cujo objetivo é estimular a vinda de pesquisadores de alto nível sediados no exterior para a criação de núcleos de investigação em universidades paulistas.
Realizado simultaneamente no IBS e no LNBio – laboratório vinculado ao Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) –, o projeto teve como objetivo principal entender os processos relacionados à formação da parede celular bacteriana – uma estrutura semirrígida que envolve todo o microrganismo e é essencial para sua sobrevivência.
“A parede celular é como uma rede de pesca formada, em grande parte, por peptidoglicano, que são moléculas de açúcar polimerizadas e associadas a peptídeos. Além de proteger a bactéria contra diferenças de pressão osmótica, essa estrutura garante a forma adequada da célula. Também é o lugar em que se associam diversos fatores de virulência [moléculas que ajudam as bactérias a driblar as defesas do sistema imune e a infectar células hospedeiras]”, explicou Dessen.
No caso de patógenos do tipo bacilo, logo após a divisão celular determinadas proteínas precisam se associar para garantir que as células filhas adquiram o formato alongado da parede celular. Forma-se, com isso, um complexo proteico conhecido como elongassoma.
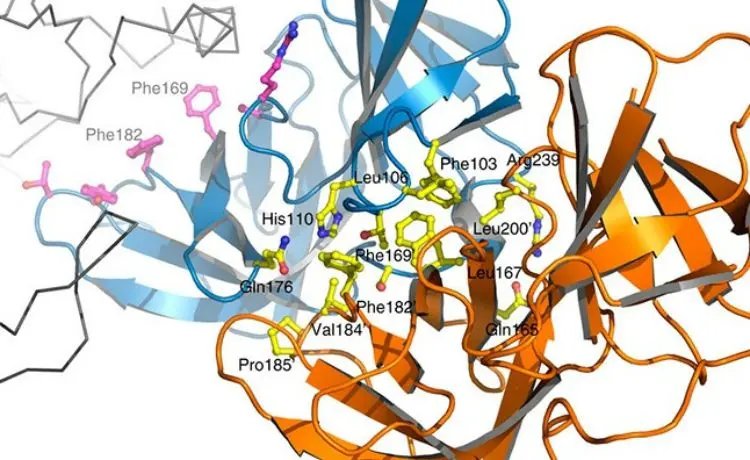
No trabalho agora publicado, o grupo conseguiu, pela primeira vez, isolar a parte central do complexo formada pelas proteínas PBP2 e MreC e elucidar sua estrutura tridimensional.
Para isso, foi adotada uma técnica conhecida como cristalografia por difração de raios X – que consiste em cristalizar proteínas e observar como esse cristal difrata a radiação emitida sobre ele. “Desse modo, foi possível entender como as duas moléculas interagem e planejar meios para inibir essa interação”, disse Dessen.
O passo seguinte foi gerar versões mutantes da MreC, com alterações nos aminoácidos situados justamente na região de interface com a PBP2. Em testes in vitro, os cientistas observaram que a proteína modificada não era mais capaz de interagir com a PBP2 para formar o complexo.
Forma arredondada
Linhagens da bactéria H. pylori modificadas geneticamente para expressar a proteína MreC mutante foram geradas por meio de uma colaboração com pesquisadores do Instituto Pasteur, na França.
O grupo observou que, quando esses microrganismos eram colocados em cultura para crescer, não conseguiam assumir o formato de cápsula e morriam em pouco tempo.
“A alteração da MreC realmente afetou o formato da parede celular. O experimento comprovou, portanto, a importância do complexo PBP2-MreC para o alongamento da parede e para a sobrevivência de bactérias do tipo bacilo. Esse conhecimento permite buscar moléculas capazes de interromper a interação entre essas proteínas e, assim, matar as bactérias”, disse Dessen.
Em princípio, a estratégia seria eficaz apenas contra espécies que apresentam a parede celular alongada. Nesse grupo encontra-se a Acinetobacter baumanni, considerada pela Organização Mundial de Saúde (OMS) um dos patógenos mais perigosos da atualidade, por ter adquirido resistência à maioria dos fármacos disponíveis.
Outra grande ameaça, segundo Dessen, é a espécie Klebsiella pneumoniae, que também tem elongassoma.
“Recentemente, uma norte-americana foi internada e morreu devido à infecção por uma cepa de K. pneumoniae resistente a 26 antibióticos diferentes. O problema da resistência bacteriana é grave e não tem recebido atenção adequada nem dos governos e nem da indústria farmacêutica. É algo que não podemos mais ignorar”, disse Dessen.
O artigo Molecular architecture of the PBP2:MreC core bacterial cell wall synthesis complex (doi:10.1038/s41467-017-00783-2), de Carlos Contreras-Martel, Alexandre Martins, Chantal Ecobichon, Daniel Maragno Trindade, Pierre-Jean Matteï, Samia Hicham, Pierre Hardouin, Meriem El Ghachi, Ivo G. Boneca a Andréa Dessen, pode ser lido em aqui.