Eletrólise é uma reação de oxirredução capaz de produzir combustível limpo
Eletrólise é uma reação química que envolve processos de oxidação e redução, desencadeados pela aplicação de uma corrente elétrica a dois compostos químicos. Essa transformação permite a conversão de energia elétrica em energia química, resultando na separação ou formação de novas substâncias.
Um exemplo prático é a eletrólise da água. Nesse processo, a eletricidade é utilizada para decompor a molécula de água (H2O) em moléculas de gás hidrogênio (H2) e gás oxigênio (O2).
Esse tipo de reação possui aplicações importantes em diferentes áreas, como a produção de gases industriais e a obtenção de metais a partir de seus minérios.
Como é o processo de eletrólise?
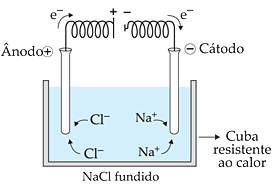
A eletrólise é um processo que utiliza um equipamento chamado célula eletrolítica, composto por quatro partes: uma fonte de corrente contínua, dois eletrodos, um eletrólito e a cuba eletrolítica, que é o recipiente onde ocorre a reação global.
Geralmente, esse equipamento é montado com uma bateria como fonte de corrente, e dois pólos (positivo e negativo) fixados em tiras de metal que são mergulhadas em água contendo algumas gotas de eletrolítico – uma substância que, quando dissolvida em água, conduz corrente elétrica.
No processo eletrolítico, cátions e ânions entram em ação. Cátions são átomos que perdem elétrons e adquirem carga positiva, enquanto ânions são átomos que ganham elétrons e ficam carregados negativamente.
As reações de oxirredução durante a eletrólise resultam em um cátion sofrendo redução no cátodo e um ânion sofrendo oxidação no ânodo. Consequentemente, a corrente elétrica flui do pólo positivo da bateria para o eletrodo cátodo. Íons de hidrogênio positivos (H+) no eletrólito recebem elétrons do eletrodo e se transformam em moléculas de hidrogênio neutras (H2).
Nesse processo, também ocorre a reação anódica. O ânodo é o eletrodo onde os elétrons se movem do eletrólito para a bateria. Ele está conectado ao segundo pólo, onde os elétrons entram na bateria. Assim, os elétrons são retirados dos íons hidróxido carregados negativamente (OH-) no eletrólito e, em seguida, são realimentados na bateria, resultando na formação de gás oxigênio.
Tipos de eletrólise
De maneira geral, existem dois tipos principais de eletrólise, a ígnea e a aquosa:
Eletrólise ígnea
A eletrólise ígnea é uma reação na qual uma substância no estado líquido, ao ser submetida a uma corrente elétrica, sofre transformações, resultando na formação de diferentes substâncias no polo negativo (cátodo) e no polo positivo (ânodo).
Nesse tipo de eletrólise, são utilizados eletrodos inertes com alta resistência ao calor, como a platina ou a grafita. Esse método é empregado para a obtenção de alumínio, metais alcalinos e alcalinos terrosos. Por exemplo, através da eletrólise do cloreto de sódio (NaCl) fundido, obtém-se gás cloro (Cl2) no ânodo, que pode ser coletado em uma solução de soda cáustica (NaOH) para a produção de hipoclorito de sódio (NaClO), e sódio metálico no cátodo.
Eletrólise aquosa
A eletrólise aquosa, também conhecida como eletrólise em meio aquoso, representa um processo químico não espontâneo em que uma corrente elétrica induz reações de oxidação e redução de íons dissolvidos em água.
Nesse caso, ao contrário da eletrólise ígnea, o cloreto de sódio (NaCl) dissolvido em água leva à produção de gás cloro (Cl2), hidrogênio (H2) e soda cáustica (NaOH).
Para que serve a eletrólise?
Extração e purificação de substâncias
Na indústria, a eletrólise desempenha um papel crucial na extração de determinadas substâncias, especialmente metais altamente reativos, os quais só podem ser obtidos a partir de seus minérios por meio desse processo eletroquímico.
Além disso, a eletrólise pode ser empregada para a purificação de metais extraídos que podem conter impurezas de outros metais. Nessa aplicação, utiliza-se uma solução aquosa contendo sal e o metal a ser purificado como eletrólito. Por exemplo, o alumínio é submetido a um processo específico de eletrólise para alcançar o grau de pureza desejado.
Produção de hidrogênio verde
O hidrogênio é um combustível limpo, que libera apenas água e energia em seu processo de combustão. Ele desempenha um papel importante na transição energética. Entretanto, seu desempenho ambiental depende diretamente do método utilizado para sua produção.
Grande parte desse elemento químico tem como origem fontes fósseis de energia, como o gás natural, em processos que liberam gases do efeito estufa na atmosfera. Estes processos geram os chamados hidrogênio cinza e hidrogênio azul.
Por outro lado, ao optarmos pela eletrólise da água, utilizando energia proveniente de fontes renováveis, é possível obter uma variante de hidrogênio mais sustentável e limpa, que é chamado de hidrogênio verde.
Sendo assim, a eletrólise da água é um processo que pode contribuir para o desenvolvimento de um sistema de energia cada vez mais livre de carbono, e o hidrogênio verde desempenha um papel muito importante para a redução das emissões de gases de efeito estufa e, consequentemente, no enfrentamento das mudanças climáticas.